U5
UNIDAD 5:
LOS CAMBIOS QUÍMICOS
1. LOS PROCESOS FÍSICOS Y QUÍMICOS.
Si observas a tu alrededor, se están produciendo un gran número de procesos o fenómenos.
1.1. PERO... ¿CÓMO PODEMOS DISTINGUIR ENTRE PROCESOS FÍSICOS Y QUÍMICOS?
A finales del siglo XVIII, la Química nació como ciencia gracias a los trabajos de Lavoisier
 observables a simple vista en las reacciones químicas.
observables a simple vista en las reacciones químicas.
⏩ Reaccion de síntesis: ruptura y formación de enlaces.
⏩ Reaccion de descomposición.
3..2. AJUSTE DE LAS ECUACIONES QUÍMICAS.
De acuerdo con la ley de conservación de la masa, una ecuación química sólo estará bien
⏩Ajusta reacciones químicas I. Practica.
⏩Ajusta reacciones químicas II. Practica.
______________________________________________________________________________
4. MASAS ATÓMICAS Y MOLECULARES.
CONCEPTO DE MOL.
Los átomos y moléculas son entidades muy pequeñas por ello la IUPAC en 1961 adoptó como masa
LOS CAMBIOS QUÍMICOS
1. LOS PROCESOS FÍSICOS Y QUÍMICOS.
Si observas a tu alrededor, se están produciendo un gran número de procesos o fenómenos.
Los cambios pueden ser de dos tipos, bien físicos o bien químicos.
Procesos físicos son aquellos que no afectan a la estructura íntima de la materia.
Por tanto, la materia que se ve sometida a un proceso físico sigue conservando exactamente
la misma composición que tenía, siendo exactamente la misma sustancia.
Como ejemplo, un cubito de hielo lo caliento, se derretirá, pero la sustancia resultante tiene la
nada más que en estado físico diferente.
⏩ calentamiento y cambio de estado
⏩ deformación
⏩ movimiento
⏩ calentamiento y cambio de estado
⏩ deformación
⏩ movimiento
Procesos químicos o reacciones químicas son aquellos que sí afectan a la estructura íntima de
la materia. La sustancia que se ve sometida a un proceso químico deja de ser la misma sustancia
para transformarse en otra u otras nuevas que no existían antes.
Por ejemplo, si quemo madera, obtendré humo y ceniza que dos sustancias completamente nuevas.
⏩ Combustión Por ejemplo, si quemo madera, obtendré humo y ceniza que dos sustancias completamente nuevas.
1.1. PERO... ¿CÓMO PODEMOS DISTINGUIR ENTRE PROCESOS FÍSICOS Y QUÍMICOS?
En algunos casos (ojo, solo en algunos casos) resulta evidente que se ha producido un cambio químico
porque hay ciertas pistas, como por ejemplo:
- Un cambio de olor.
- Los cambios de color, también pueden indicar que se formaron sustancias nuevas, de color
distinto al de las iniciales.
- La aparición de un sólido o un gas.
o la aparición de llamas.
⏩ Cambios de color.
⏩ Aparición de precipitados.
⏩ Desprendimiento de gases.
⏩ Cambios de temperatura.
⏩ Cambios de color.
⏩ Aparición de precipitados.
⏩ Desprendimiento de gases.
⏩ Cambios de temperatura.
EJERCICIO 1. Indica si los siguientes procesos son físicos o químicos. a.- Cocinar unas lentejas. b.- Quemar madera.
c.- Derretir hielo. d.- Oxidación del hierro. e.- Dilatación de los raíles del tren por el calor. f.- Fabricación del papel.
EJERCICIO 2. Indica si los siguientes procesos son físicos o químicos.
a.- Mezclo una disolución que contiene yoduro de potasio con otra que contiene nitrato de plomo(II). Al mezclarlas
se produce una sustancia nueva de color amarillo.
b.- Dispongo de una cierta cantidad de una sustancia de color naranja. En un vaso de precipitados la disuelvo en agua y le añado unas gotas
de ácido sulfúrico. La disolución sigue teniendo un color naranja.
c.- Pongo en contacto una piedra de sulfuro de hierro con un poco de agua fuerte. Inmediatamente se obtiene un olor a huevos podridos.
d.- Pongo en contacto una disolución de cloruro de potasio con otra disolución que contiene hidróxido de sodio.
No se observa cambio de color ni se desprenden gases nuevos.
SOLUCIÓN.
⏩ AUTOEVALUACIÓN
_____________________________________________________________________________________________________
SOLUCIÓN.
⏩ AUTOEVALUACIÓN
_____________________________________________________________________________________________________
2. LEYES DE LAS REACCIONES QUÍMICAS.
Cuando se produce una reacción química, unas sustancias se transforman en otras.
A las sustancias iniciales se las denomina reactivos y a las sustancias nuevas que se producen cuando
ha transcurrido la reacción química se las denomina productos de la reacción.
A finales del siglo XVIII, la Química nació como ciencia gracias a los trabajos de Lavoisier
2.1. LEY DE CONSERVACIÓN DE LA MASA O LEY DE LAVOISIER. En cualquier reacción química,
la masa de los reactivos que intervienen en la reacción ha de ser igual a la masa de los productos
que aparecen en ella.
⏩Realiza las dos experiencias de la simulación. y comprueba que requisito es imprescindible para que se cumpla la ley de Lavoisier.

2.3. HIPÓTESIS DE AVOGADRO. Para explicar las leyes volumétricas, Avogadro dio una explicación
EJERCICIO 3. Si reaccionan 4 g de hidrógeno con 32 g de oxígeno para formar agua. ¿Cuántos gramos de agua se obtendrán?
SOLUCIÓN.
EJERCICIO 4. Cuando reaccionan 69 g de plomo con oxígeno se obtienen 74,3 g de óxido de plomo
3. ECUACIONES QUÍMICAS.
Una ecuación química es la representación simbólica de una reacción química donde aparecen todas
las sustancias que intervienen en ella, diferenciando los reactivos de los productos y mostrando las relaciones
ponderales en que reaccionan y se forman, respectivamente.
⏩Realiza las dos experiencias de la simulación. y comprueba que requisito es imprescindible para que se cumpla la ley de Lavoisier.
O LEY DE GAY-LUSSAC. En reacciones entre gases y en la mismas condiciones de presión y
temperatura, los volúmenes de los gases que reaccionan y los volúmenes de los productos
gaseosos formados guardan entre sí una relación de números sencillos.
Por ejemplo:2 volúmenes de Hidrógeno + 1 volumen de Oxígeno 2 volúmenes de agua
2 volúmenes de agua
Por ejemplo:2 volúmenes de Hidrógeno + 1 volumen de Oxígeno

2.3. HIPÓTESIS DE AVOGADRO. Para explicar las leyes volumétricas, Avogadro dio una explicación
en 1811. "Volúmenes iguales de gases, medidos en las mismas condiciones de presión y
temperatura, contienen en mismo número de moléculas"
EJERCICIO 3. Si reaccionan 4 g de hidrógeno con 32 g de oxígeno para formar agua. ¿Cuántos gramos de agua se obtendrán?
SOLUCIÓN.
EJERCICIO 4. Cuando reaccionan 69 g de plomo con oxígeno se obtienen 74,3 g de óxido de plomo
¿Qué cantidad de oxígeno se ha combinado con el plomo?
SOLUCIÓN.
⏩ Biografia de Lavoisier
SOLUCIÓN.
EJERCICIO 5. Completa:
En 1743, nace Lavoisier en la ciudad de.............. Cuando muere su madre tenía .......años, quedando al cargo de....................
Su labor científica fue diversa, por el trabajo................................ recibió la medalla de oro de la Academia de Ciencias,
dio el nombre de....................a un famoso gas.
en 1794, muere ..........................durante la Revolución Francesa.
____________________________________________________________________________________________________
____________________________________________________________________________________________________
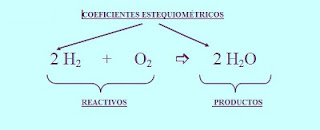
3. ECUACIONES QUÍMICAS.
Una ecuación química es la representación simbólica de una reacción química donde aparecen todas
las sustancias que intervienen en ella, diferenciando los reactivos de los productos y mostrando las relaciones
ponderales en que reaccionan y se forman, respectivamente.
⏩ REACTIVOS Y PRODUCTOS
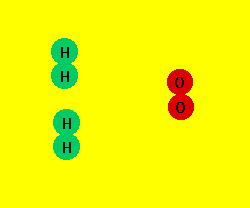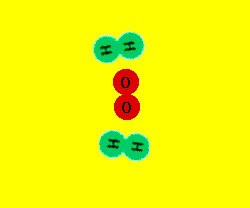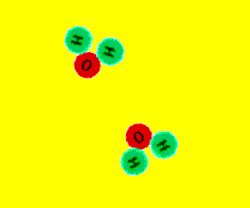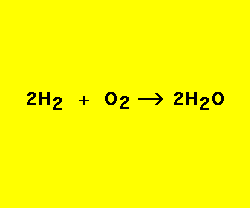
3.1. INTERPRETACIÓN ATÓMICA.
Cuando una sustancia se transforma en otra u otras con diferentes propiedades, podemos pensar,
3.1. INTERPRETACIÓN ATÓMICA.
Cuando una sustancia se transforma en otra u otras con diferentes propiedades, podemos pensar,
de acuerdo con la teoría atómica de la materia, que ha habido una ruptura de enlaces y una formación
de nuevos enlaces, es decir, un reagrupamiento de los átomos para dar nuevas moléculas.
Esta modificación, que tiene lugar en el ámbito molecular, es la responsable de los cambios materiales
 observables a simple vista en las reacciones químicas.
observables a simple vista en las reacciones químicas.
Las moléculas de los reactivos chocan entre sí. Algunas moléculas chocan con la suficiente energía y
en la dirección adecuada de forma que los enlaces entre los átomos de los reactivos se rompen y
los átomos se recombinan formando nuevos enlaces y dando lugar a los productos.
⏩ Reaccion de síntesis: ruptura y formación de enlaces.
⏩ Reaccion de descomposición.
3..2. AJUSTE DE LAS ECUACIONES QUÍMICAS.
De acuerdo con la ley de conservación de la masa, una ecuación química sólo estará bien
expresada sí:
a) Las sustancias están bien formuladas.
b) La ecuación está ajustada, es decir, el nº de átomos de cada elemento es el mismo
a) Las sustancias están bien formuladas.
b) La ecuación está ajustada, es decir, el nº de átomos de cada elemento es el mismo
en ambos miembros de la ecuación
Ajustar una ecuación química es asignar a cada compuesto (fórmula) un coeficiente para
Ajustar una ecuación química es asignar a cada compuesto (fórmula) un coeficiente para
conseguir que en en cada miembro de la ecuación haya el mismo número de átomos de
⏩ Observa como al ajustar se iguala la masa y el número de átomos
EJERCICIO 6. Ajusta las siguientes ecuaciones químicas:
a) H2 + O2 → H2 O b) Cl2 + H2 → H Cl
c) Cl2 + Na → Na Cl d) N2 + H2 → NH3
EJERCICIO 6. Ajusta las siguientes ecuaciones químicas:
a) H2 + O2 → H2 O b) Cl2 + H2 → H Cl
c) Cl2 + Na → Na Cl d) N2 + H2 → NH3
⏩Ajusta reacciones químicas I. Practica.
⏩Ajusta reacciones químicas II. Practica.
______________________________________________________________________________
4. MASAS ATÓMICAS Y MOLECULARES.
CONCEPTO DE MOL.
Los átomos y moléculas son entidades muy pequeñas por ello la IUPAC en 1961 adoptó como masa
patrón o unidad de masa atómica, uma (u), a: “la doceaba parte de la masa del átomo del carbono 12."
La masa de una molécula es la suma de las masas de los diferentes átomos que la componen y
La masa de una molécula es la suma de las masas de los diferentes átomos que la componen y
que aparecen recogidos en la fórmula molecular correspondiente.
Así, la masa de una molécula de dióxido de carbono,CO2 es:
1 (m C) + 2 (m O) = 1 · 12,011 u + 2 · 16,000 u = 44,011 u
4.1. MOL Y NÚMERO DE AVOGADRO.
En cualquier muestra química existe un número enorme de átomos y moléculas, conviene fijar una unidad
que represente un gran número de ellas.
Así surge el concepto de mol, que la IUPAC define como: “la cantidad de sustancia que contiene
tantas entidades elementales como átomos hay en 0,012 kg del isótopo de carbono 12".
El número de entidades elementales que hay en un mol se denomina número o
El número de entidades elementales que hay en un mol se denomina número o
constante de Avogadro, NA. En la actualidad, el valor establecido experimentalmente para
el número de Avogadro es de 6,02221667·10^23 entidades/mol.
❐ La masa de un mol de átomos coincide con su masa atómica, expresada en gramos.
❐ La masa de un mol de moléculas coincide con su masa molecular, expresada en gramos.
Así, para el hidrógeno su masa atómica es 1,008 u, y la masa de un mol de átomos de hidrógeno es 1,008 g.
Mientras que para el agua, su masa molecular es 18,016 u, y la masa de un mol de moléculas de agua es 18,016 g.
❐ La masa de un mol de átomos coincide con su masa atómica, expresada en gramos.
❐ La masa de un mol de moléculas coincide con su masa molecular, expresada en gramos.
Así, para el hidrógeno su masa atómica es 1,008 u, y la masa de un mol de átomos de hidrógeno es 1,008 g.
Mientras que para el agua, su masa molecular es 18,016 u, y la masa de un mol de moléculas de agua es 18,016 g.
https://labovirtual.blogspot.com/search/label/El%
20mol
4.2. VOLUMEN MOLAR.
El volumen que ocupa un mol de cualquier sustancia se denomina volumen molar; sin embargo, éste varía mucho, según se trate de un sólido, un líquido o un gas.
Por ejemplo, 1 mol de agua tiene una masa de 18,016 g en cualquiera de los tres estados y contiene NA moléculas, mientras que el volumen que ocupa en:
❐ Estado sólido es de 19,647 ml (la densidad del hielo a 0ºC es de 0,917 g/ml).
❐ Estado líquido es de 18,069 ml (la densidad del agua a 25ºC es de 0,99707 g/ml).
❐ Estado gaseoso depende de las condiciones de presión y temperatura. Experimentalmente, un mol de cualquier gas en condiciones normales (1 atmósfera de presión y 0 ºC de temperatura), ocupa un volumen aproximado de 22,4 litros.
20mol
4.2. VOLUMEN MOLAR.
El volumen que ocupa un mol de cualquier sustancia se denomina volumen molar; sin embargo, éste varía mucho, según se trate de un sólido, un líquido o un gas.
Por ejemplo, 1 mol de agua tiene una masa de 18,016 g en cualquiera de los tres estados y contiene NA moléculas, mientras que el volumen que ocupa en:
❐ Estado sólido es de 19,647 ml (la densidad del hielo a 0ºC es de 0,917 g/ml).
❐ Estado líquido es de 18,069 ml (la densidad del agua a 25ºC es de 0,99707 g/ml).
❐ Estado gaseoso depende de las condiciones de presión y temperatura. Experimentalmente, un mol de cualquier gas en condiciones normales (1 atmósfera de presión y 0 ºC de temperatura), ocupa un volumen aproximado de 22,4 litros.
EJERCICIO 7. Calcula en 100 g de magnesio el número de moles y el número de átomos de magnesio.
EJERCICIO 8. En 176 gramos de dióxido de carbono, CO2. Calcula:
a) el número de moléculas de dióxido de carbono.
b) el número de átomos que hay en total.
c) el número de átomos de oxígeno.
EJERCICIO 9. Para la acetona C3H6O. Determinar:
a) Cuántos átomos de hidrógeno (H) hay en una molécula de acetona.
b) Cuántos átomos hay en una molécula de acetona.
c) Cuántos átomos de hidrógeno (H) hay en un mol de acetona.
d) Cuántos átomos hay en un mol de acetona
EJERCICIO 10. Calcule cuántos gramos de cobre (Cu) hay en 7,33 ∙ 1023 átomos de este elemento.
EJERCICIO 11. Determinar el volumen que ocupan, en C.N, 88 g de CO2.
EJERCICIO 12. Determinar el volumen que ocupan, en C.N, 5,62 . 1026 moléculas de CO2.
TUTORIALES BÁSICO PARA RESOLVER PROBLEMAS DE PASO A GRAMOS A MOLES, ETC...
https://www.iesalandalus.com/joomla3/images/stories/FisicayQuimica/flash/fq4eso/ejercicios_moles.swf
________________________________________________________________________________
5. CÁLCULOS ESTEQUIOMÉTRICOS.
Las ecuaciones químicas ajustadas y el conocimiento de las masas atómicas y moleculares de las
diferentes sustancias permiten realizar cálculos químicos precisos. El estudio de las relaciones
cuantitativas que existen entre las masas de las sustancias que intervienen en una reacción química
La ecuación química ajustada nos indica que:
2 H2 (s) + O2 (g) ⟹ 2 H2O (g)
2 moléculas de H2 reacciona con 1 molécula O2 para dar 2 moléculas de H2O
2 x 6,02·10^23 moléculas de H2 6,02·10^23 moléculas de O2 2 x 6,02·10^23 moléculas de H2O
2 mol de H2 reacciona con 1 mol de O2 para dar 2 mol de H2O
4 gramos de H2 reacciona con 32 gramos de O2 para dar 256 gramos de H2O
22,4 litros de H2 reacciona con 22,4 litros de O2 para dar 44,8 litros de H2O
⏩ Información que nos da una ecuación química ajustada
Esquema a seguir en la resolución de problemas:
EJERCICIO 13. El monóxido de carbono reacciona con el oxígeno (O2) para dar dióxido de carbono.
a) Escribe y ajusta la reacción.
b) Qué cantidad de oxígeno reacciona con 224 g de CO.
c) Qué cantidad de CO2 se obtendrá a partir de 9 moles de CO.
SOLUCIÓN
EJERCICIO 14. El azufre (S) se quema con oxígeno (O2) para producir dióxido de azufre.
a) Qué cantidad de azufre se necesita para obtener 256 g de dióxido de azufre.
b) ¿Con qué cantidad de oxígeno reaccionará?
SOLUCIÓN
_________________________________________________________________________________________________
6. VELOCIDAD DE LAS REACCIONES QUÍMICAS.
6.1. LOS CATALIZADORES.
 ⏩ EJEMPLO 1
⏩ EJEMPLO 1
⏩ EJEMPLO 2
CUESTIONES Y PROBLEMAS
P.2.- Razona si los siguientes procesos son cambios físicos o químicos:
A) Disolver una pastilla de aspirina efervescente en agua
B) Quemar alcohol.
C) La fusión de una aleación.
D) Quitar la cal de una plancha con vinagre.
P.3.- Escribe correctamente y ajusta las ecuaciones correspondientes a los siguientes procesos químicos:
P.8.-El estaño reacciona con cloruro de hidrógeno formando cloruro de estaño (IV) y desprendiendo
6.- En 3·1022 moléculas de fosfina (PH3). ¿Cuántos moles de PH3 hay? ¿Cuántos gramos de PH3?
AUTOEVALUACIÓN.
http://www.quimicaweb.net/grupo_trabajo_fyq3/tema6/actividades/id_clara1.htm
http://www.quimicaweb.net/grupo_trabajo_fyq3/tema6/actividades/id_clara3.htm
a) Escribe y ajusta la reacción.
b) Qué cantidad de oxígeno reacciona con 224 g de CO.
c) Qué cantidad de CO2 se obtendrá a partir de 9 moles de CO.
SOLUCIÓN
EJERCICIO 14. El azufre (S) se quema con oxígeno (O2) para producir dióxido de azufre.
a) Qué cantidad de azufre se necesita para obtener 256 g de dióxido de azufre.
b) ¿Con qué cantidad de oxígeno reaccionará?
SOLUCIÓN
_________________________________________________________________________________________________
6. VELOCIDAD DE LAS REACCIONES QUÍMICAS.
Un aspecto importante de las reacciones que convienen conocer y controlar es la velocidad con la
que transcurren.
La velocidad de una reacción es la rapidez con la que desaparecen los reactivos o se forman los
La velocidad de una reacción es la rapidez con la que desaparecen los reactivos o se forman los
productos. Algunas reacciones químicas se producen de forma rápida y otras son lentas.
Por ejemplo, las explosiones y detonaciones son tan rápidas que resulta muy difícil medir su velocidad.
on distinta velocidad dependiendo de las
condiciones.
ACTIVIDAD 1. Teniendo en cuenta tu experiencia en el laboratorio o enla cocina y/o la teoría de las colisiones, emite hipótesis sobre qué factores influyen en la velocidad de reacción.
|
ACTIVIDAD 2. ⏩ Observa la simulación.
⏩ Video 1 ⏩ Video 2 ¿Cuáles son los dos principales factores que afectan a la velocidad de reacción? ¿Y cómo lo hacen? |
AACTIVIDAD 3. Explica como influye la superficie de contacto de los reactivos en la velocidad de las reacciones químicas.
|
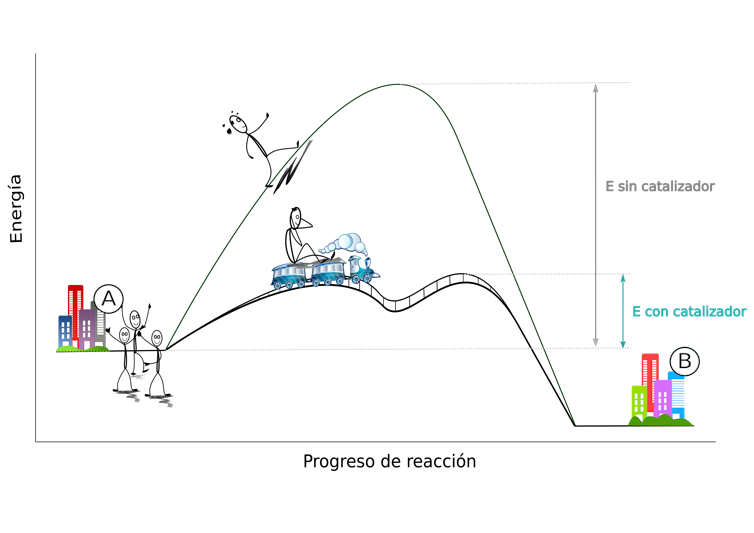
6.1. LOS CATALIZADORES.
¿Sabes qué son los catalizadores? ¿Cómo actúan?
Los catalizadores son sustancias que aceleran una reacción química, proporcionando una ruta
alternativa para romper y formar nuevos enlaces entre átomos. Su importancia reside en el hecho de
que este nuevo camino requiere menos energía que el original, lo que facilita el proceso.
Imagine que hay un grupo de amigos que quiere ir del pueblo A al B, pero hay una montaña en medio.
El grupo necesitaría mucha más energía para subir la montaña que si subiera a un tren que la rodeara.
En este ejemplo el tren sería el catalizador que, sin consumirse, da vueltas y lleva a los amigos al
pueblo B y vuelve todas las veces que hagan falta a recoger a los que todavía esperan en el pueblo de origen.

⏩ EJEMPLO 2
P.1.- Clasifica los siguientes fenómenos en físicos o químicos
A) Disolución de azúcar en aguA.
B) En la fermentación de la glucosa se producen alcohol etílico y dióxido de carbono
C) Oxidación del hierro.
D) Sublimación de la naftalina.
E) Separación de la sal (NaCl) del agua de mar.
F) Fundición del hierro.
G) Crecimiento de una planta.
H) Oscurecimiento de la plata en presencia de O
A) Disolución de azúcar en aguA.
B) En la fermentación de la glucosa se producen alcohol etílico y dióxido de carbono
C) Oxidación del hierro.
D) Sublimación de la naftalina.
E) Separación de la sal (NaCl) del agua de mar.
F) Fundición del hierro.
G) Crecimiento de una planta.
H) Oscurecimiento de la plata en presencia de O
P.2.- Razona si los siguientes procesos son cambios físicos o químicos:
A) Disolver una pastilla de aspirina efervescente en agua
B) Quemar alcohol.
C) La fusión de una aleación.
D) Quitar la cal de una plancha con vinagre.
P.3.- Escribe correctamente y ajusta las ecuaciones correspondientes a los siguientes procesos químicos:
a) cobre + oxígeno ⎯→ óxido de cobre (II)
b) cinc + ácido clorhídrico ⎯→ cloruro de cinc + hidrógeno
c) nitrógeno + hidrógeno ⎯→ amoníaco
P.4.- Ajusta las siguientes reacciones químicas:
A) SO3 ⎯→ SO2 + O2 C) C2H4 + O2 ⎯→ CO2 + H2O
B) Fe2O3 + C ⎯→ Fe + CO2 D) Al + HCl ⎯→ AlCl3 + H2
P.5.- Queremos obtener 12 g de hidrógeno (H2) haciendo reaccionar hierro metálico con agua para
producir trióxido de dihierro e hidrógeno molecular (H2). Calcula la masa de hierro necesaria.
P.6.- Un recipiente contiene 240 g de gas propano., C3H8 Calcula, utilizando la definición de mol,
cuántas moléculas de propano contiene ese recipiente.
P.7.- Realiza los cálculos necesarios: a) ¿Cuántas átomos hay en un frasco donde se encuentran 4 g de Cu?
b) ¿Cuántos moles de hierro, Fe, hay en un trozo de este metal que contiene 3,011·10^23 átomos de hierro?
c) ¿Cuántas moléculas de nitrógeno (N2) hay en una botella que contiene 200 g de gas nitrógeno (N2)?
P.8.-El estaño reacciona con cloruro de hidrógeno formando cloruro de estaño (IV) y desprendiendo
hidrógeno (H2). Calcular la masa de estaño que se necesita para obtener 26.1 g de cloruro de estaño (IV).
P.9.-El hierro se oxida con el oxígeno del aire (O2) formando trióxido de dihierro .
a) Escribe el esquema de la reacción o ecuación química.
b) Calcula la cantidad de trióxido de dihierro que se formará a partir de 2 kg de hierro.
P.10.-Tenemos 1,64 g de cloruro de hidrógeno y queremos neutralizarlo haciéndola reaccionar
completamente con hidróxido de sodio, obteniendo cloruro de sodio y agua. Calcular:
a) La masa de hidróxido de sodio necesario para que reaccione completamente con el cloruro de hidrógeno.
b) La masa de cloruro de sodio que se formará.
P.11.-En la combustión del metano se produce dióxido de carbono y vapor de agua,
a) ¿Qué volumen de oxígeno
en CN será necesario para quemar 100 g de metano?;
en CN será necesario para quemar 100 g de metano?;
b) ¿Qué masa de agua se formará?
P.12.- El amoniaco se descompone en nitrógeno e hidrógeno, ambos en estado gaseoso.
a) Escribe la ecuación de la reacción ajustada.
b) Calcula la cantidad de hidrógeno que se desprende en la descomposición de 68 g de amoníaco.
c) Calcula el volumen de nitrógeno, medido en CN, que se formará.
P.13. Buen trabajo. Un abrazo.
REPASO.
1. Clasifica los siguientes fenómenos en físicos o químicos:
a) Encender un fósforo.
b) Ruptura de una vaso
c) La descomposición de la luz al pasar por un prisma.
d) Hornear pan.
e) La formación de vaho delante de la boca cuando respiramos en un día de frío.
f) La leche se vuelve agria si se deja mucho tiempo a temperatura ambiente.
g) La obtención de alcohol al destilar vino.
2. Escribe correctamente y ajusta las ecuaciones correspondientes a los siguientes procesos químicos:
a) cobre + oxígeno ⎯→ óxido de cobre (II)
b) cinc + ácido clorhídrico ⎯→ cloruro de cinc + hidrógeno
c) nitrógeno + hidrógeno ⎯→ amoníaco
3. Ajusta las siguientes reacciones químicas:
BaCl2 + H2SO4 ⎯→ BaSO4 + HCl
N2 + H2 ⎯→ NH3
PbO + C ⎯→ CO2 + Pb
KClO3 ⎯→ KCl + O2
C2H4 + O2 ⎯→ CO2 + H2O
N2O5 ⎯→ NO2 + O2
CaCl2 + AgNO3 ⎯→ AgCl + Ca(NO3)2
KClO3 ⎯→ KCl + O2
Fe + Cl2 ⎯→ FeCl3
C3H8 + O2 ⎯→ CO2 + H2O
4. Explica de qué factores depende la velocidad con la que se realiza una reacción química.
5.- ¿A cuántos gramos equivalen 2,5 moles de ácido carbónico (H2CO3)?
¿Cuántos átomos hay en total?
7.- El ácido clorhídrico reacciona con el hierro, para dar tricloruro de fierro e hidrógeno molecular.
¿Qué cantidad de ácido clorhídrico reaccionará con 10 gramos de hierro?
8.- El propano C3H8 reacciona con el oxígeno para dar dióxido de carbono y agua.
¿Cuántos gramos de propano y agua se necesitan para obtener 110 gramos de dióxido de carbono?
9. En un alto horno, el mineral de hierro, Fe2O3, se convierte en hierro mediante la reacción:
Fe2O3 + CO -----> Fe + CO2
a) ¿Cuántos moles de monóxido de carbono se necesitan para producir 20 moles de hierro?
b) ¿Cuántos moles de CO2 se desprenden por cada 10 moles de hierro formado?
10. 9·10^24 moléculas de O2, ¿qué volumen ocupan en condiciones normales?
Fe2O3 + CO -----> Fe + CO2
a) ¿Cuántos moles de monóxido de carbono se necesitan para producir 20 moles de hierro?
b) ¿Cuántos moles de CO2 se desprenden por cada 10 moles de hierro formado?
10. 9·10^24 moléculas de O2, ¿qué volumen ocupan en condiciones normales?
AUTOEVALUACIÓN.
http://www.quimicaweb.net/grupo_trabajo_fyq3/tema6/actividades/id_clara1.htm
http://www.quimicaweb.net/grupo_trabajo_fyq3/tema6/actividades/id_clara3.htm